快讯 | 特瑞思TRS005临床试验申请获受理
2024年02月01日
新春将至,喜讯先来!特瑞思药业于2月1日收到国家药品监督管理局签发的《受理通知书》(受理号:CXSL2400084),公司申报的TRS005临床试验申请已获得正式受理。
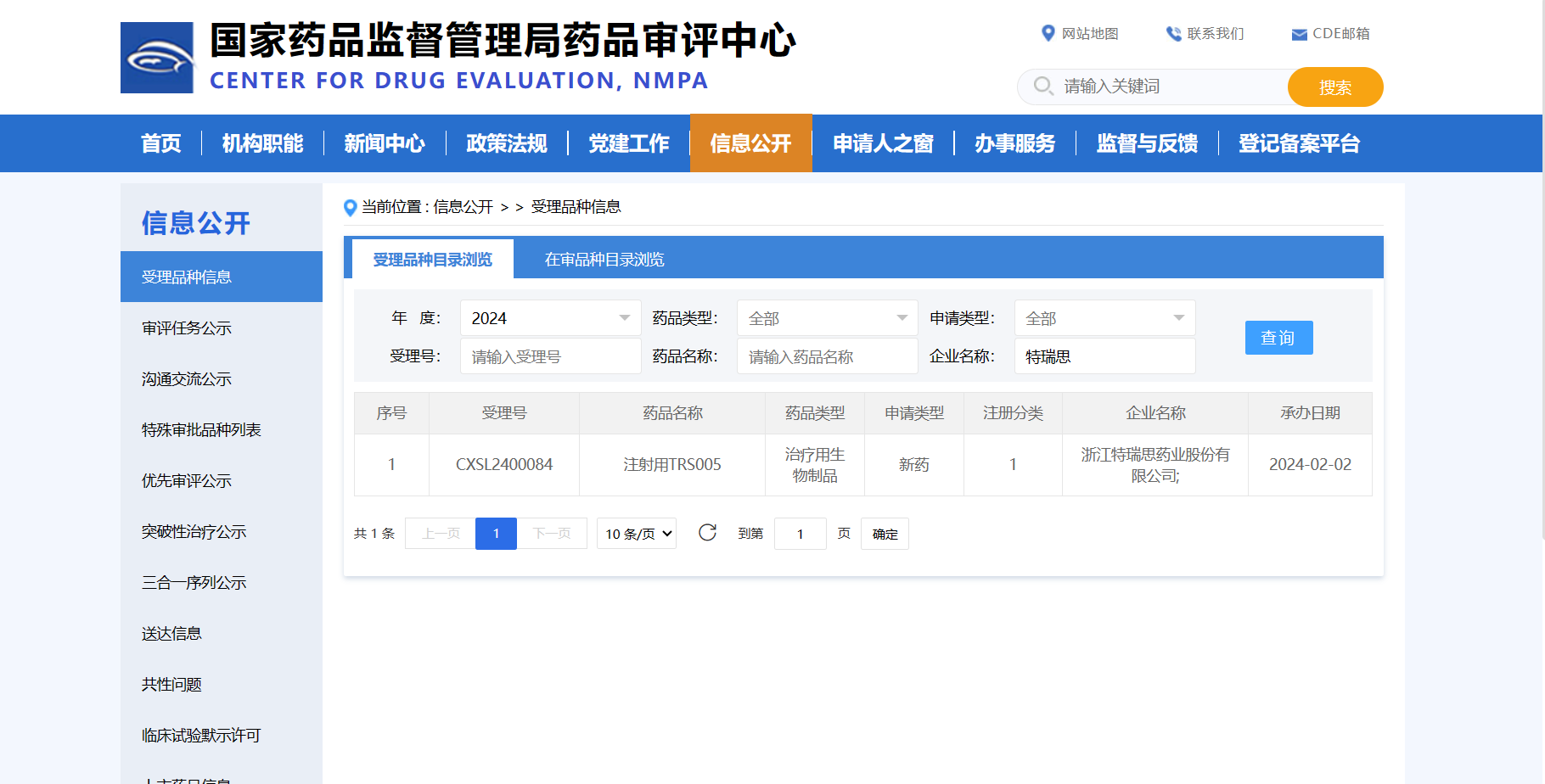
此次临床试验申请受理是TRS005项目取得的又一里程碑进展。近一年多来,TRS005陆续取得的振奋人心的阶段性成果,离不开特瑞思现有领导班子的科学顶层规划,离不开现有技术团队的勠力同心,与时间比拼,与困难博弈,以科学严谨的态度诠释敬业与专业。
关于TRS005
TRS005是特瑞思自主研发的一款拟用于CD20阳性非霍奇金淋巴瘤的创新型抗体偶联药物。目前已获得的临床试验数据显示,在安全性和有效性(主要疗效指标包括ORR、PFS等)方面,TRS005具备优于相关竞品的潜力,即将进入关键临床研究阶段。此次临床试验申请将进一步探索TRS005在非霍奇金淋巴瘤治疗中的更多临床价值。
关于特瑞思
浙江特瑞思药业股份有限公司于2010年成立于浙江湖州,是一家以临床用药需求为导向的创新生物药研发生产企业,专注于抗体类药物的研发、中试及放大生产,产品管线涵盖创新抗体偶联药物(ADC)、生物类似药及改良型单抗药物等。公司以“患者有医,医者有药”为宗旨,致力于研发生产质量优越且价格可及的抗肿瘤单抗类药物,以解决尚未满足的临床需求。
业务合作联系人:
商务合作:熊女士,13735103231,feng.xiong@teruisipharm.com
融资合作:沈女士,13585547598,xiaoli.shen@teruisipharm.com






