【2024 ASCO】特瑞思TRS005治疗复发/难治性非霍奇金淋巴瘤Ib期扩展组数据首次公布
2024年美国临床肿瘤学会(ASCO)于5月31日至6月4日(美国中部夏令时间,CDT)于美国芝加哥召开。作为全球肿瘤学术领域的权威盛会,其公布的最新科研成果,有望在很大程度上影响肿瘤临床治疗策略和临床实践。
当地时间6月1日,特瑞思与中国医学科学院肿瘤医院石远凯教授(Leading PI)、中山肿瘤防治中心李志铭教授和郴州市第一人民医院梁欣荃主任携TRS005针对复发/难治性非霍奇金淋巴瘤受试者的最新研究成果亮相2024 ASCO会议。这是继2022年ESMO大会之后,TRS005首次在ASCO年会上展示其积极的研究数据。

石远凯教授(中)、李志铭教授(左)和梁欣荃主任(右)现场合影
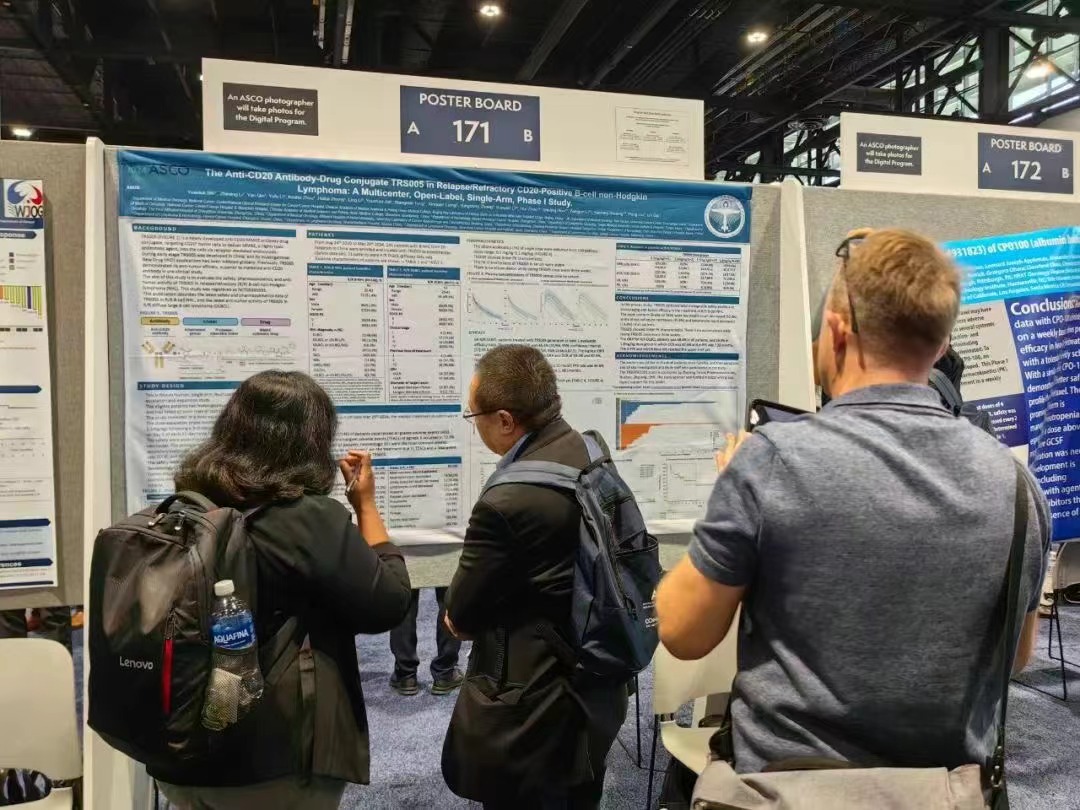
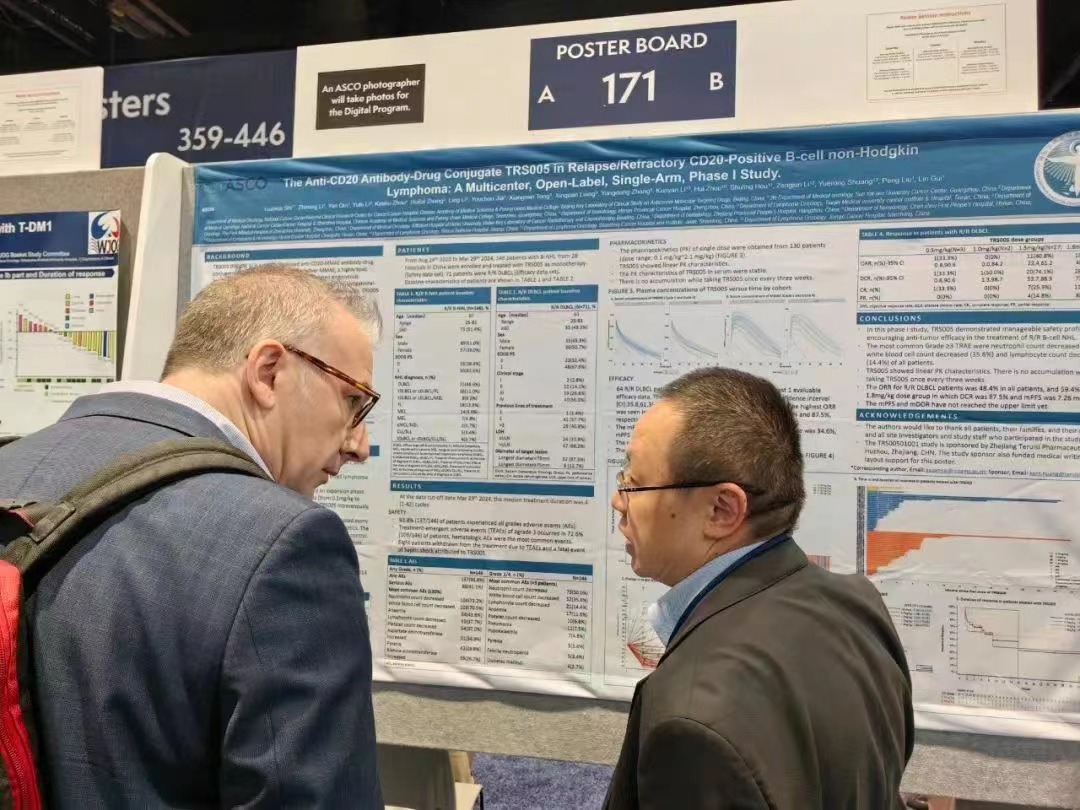
李志铭教授向参会人员介绍TRS005
背景
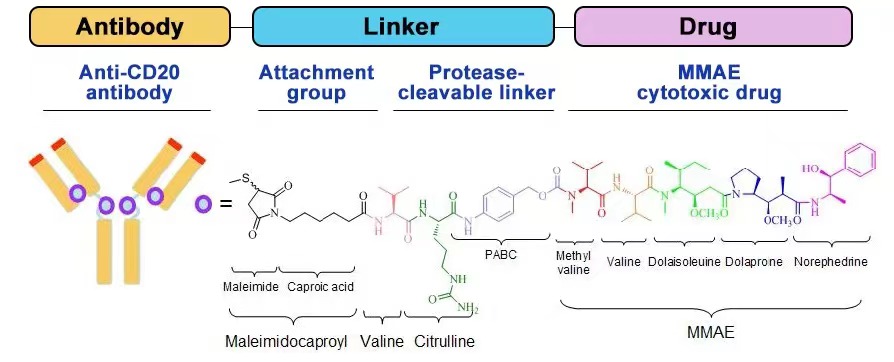
TRS005是特瑞思自主研发的抗CD20单抗-MMAE偶联剂,靶向CD20+肿瘤细胞,通过受体介导的内吞作用将MMAE递送到细胞中。
TRS005早期布局在国内研发,已于2024年3月先后获准开展单臂II期关键临床试验,并纳入了突破性治疗药物程序,现已启动在全球范围内的新药研究计划。
本次会议公布了TRS005在复发/难治性B细胞非霍奇金淋巴瘤(R/R B-NHL)患者中最新Ib期扩展组临床疗效及安全性数据,有望为患者提供更优的治疗方案。
研究方法
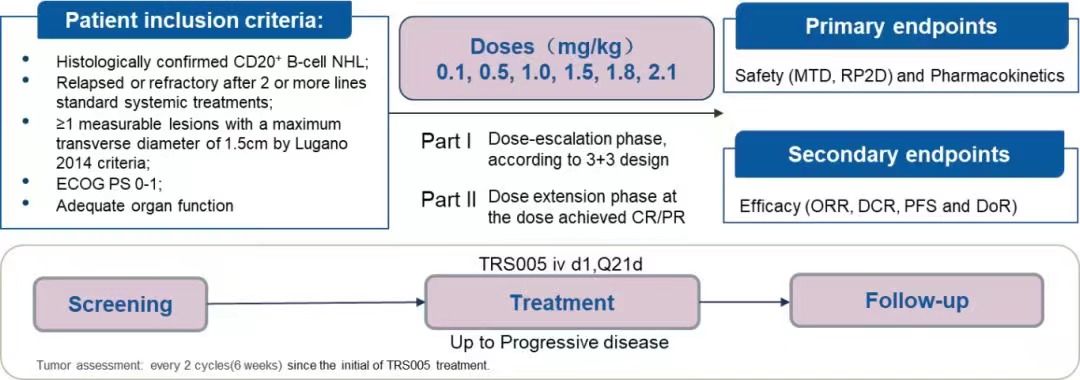
整体研究包括剂量递增阶段和剂量拓展阶段。在剂量递增阶段,对至少接受过2个标准治疗方案后出现复发或难治的患者采用“3+3”原则以6个剂量组递增。每例受试者按照21天为周期的连续给药6次,共6个周期。每隔一个周期评价安全性,每隔两个周期评价疗效。主要终点是安全性和药代动力学。次要终点是研究人员评估的客观缓解率(ORR)、疾病控制率(DCR)和无进展生存期(PFS)。
在剂量拓展阶段,基于剂量递增阶段的药代动力学数据、安全耐受性及疗效数据,选取1.5mg/kg和1.8mg/kg两个剂量组进入复发难治的CD20阳性弥漫大B细胞淋巴瘤(R/R DLBCL)亚型剂量拓展阶段。经研究者判断可继续用药的受试者,持续治疗直至其出现不能耐受、疾病进展或死亡,以先发生者为准。
研究结果
截至2024年3月29日,已有146例CD20阳性的B细胞非霍奇金淋巴瘤患者接受了TRS005单药治疗,其中71名患者为R/R DLBCL,中位治疗时间为4个周期。
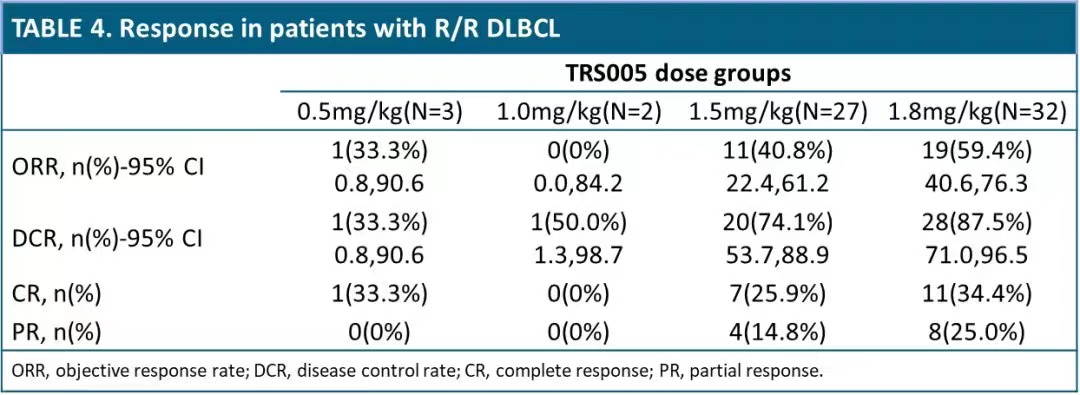
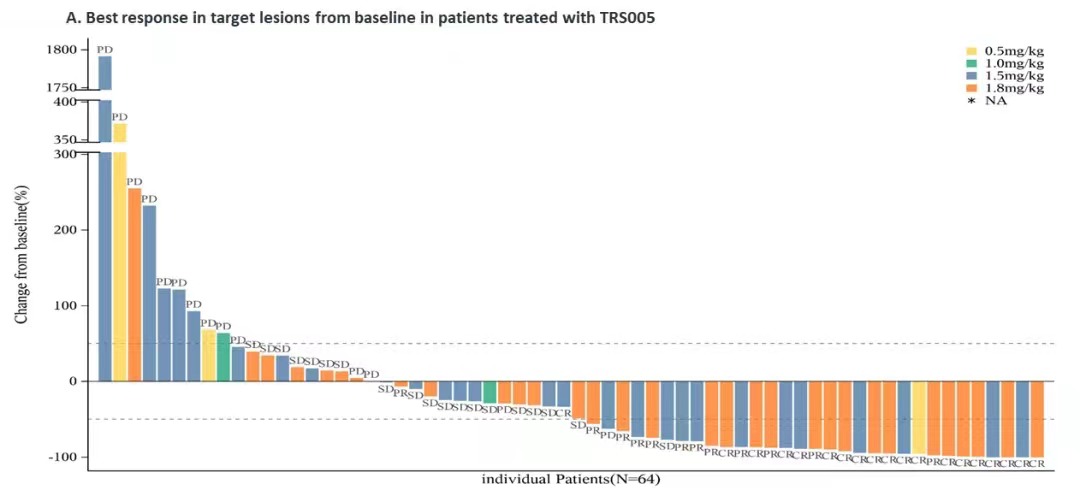
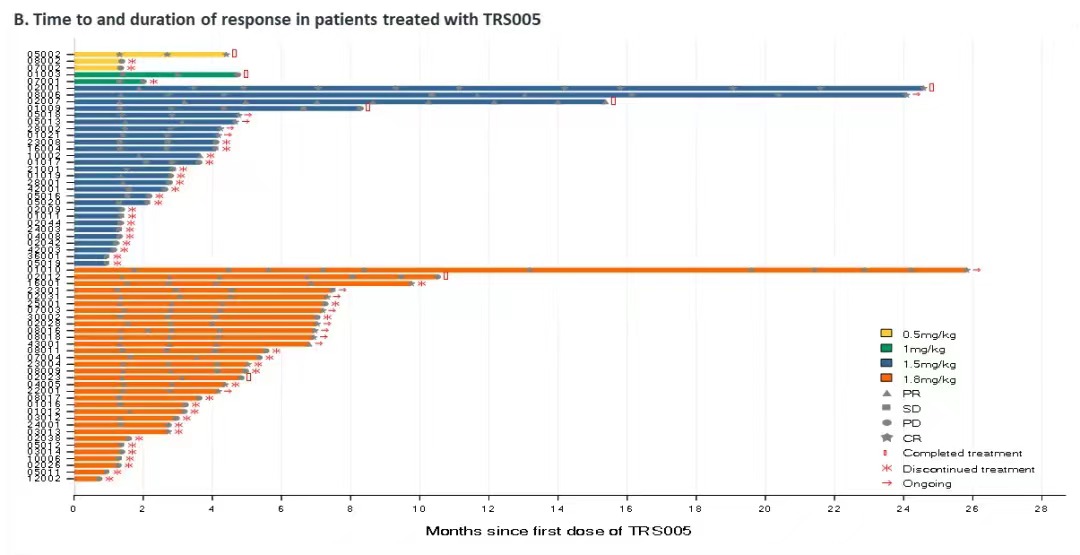
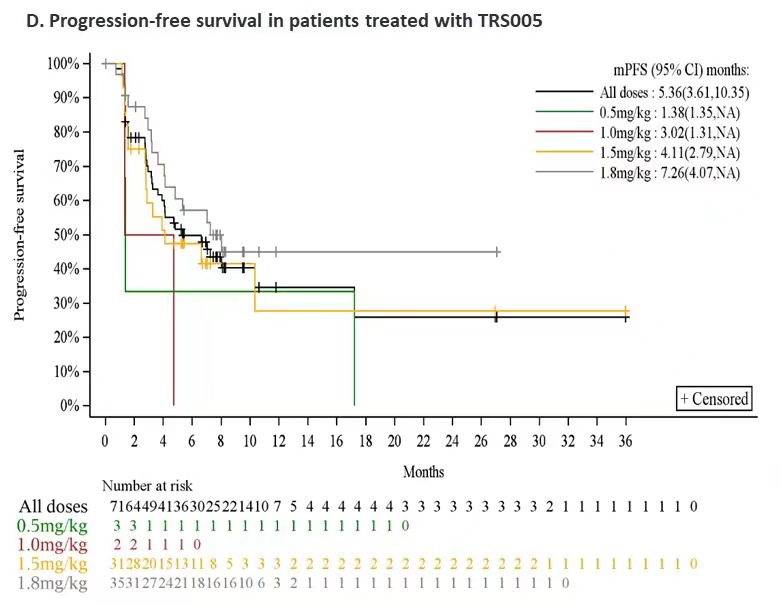
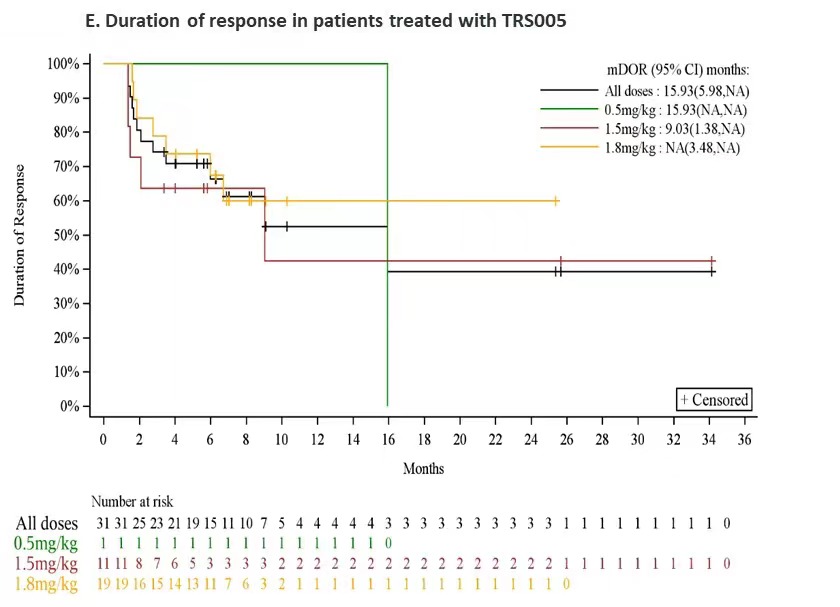
对完成了至少一次用药后疗效评价的64例R/R DLBCL患者进行分析,整体ORR为48.4%(95% CI:35.8,61.3),DCR为78.1%(95% CI:66.0,87.5),mPFS为5.4个月,12个月PFS率为34.6%,mDOR为15.9个月。其中1.8mg/kg剂量组疗效信号明显,ORR、DCR、mPFS分别为59.4%、87.5%和7.26个月,目前疗效数据还在积累中,mPFS和mDOR还未到达上限。
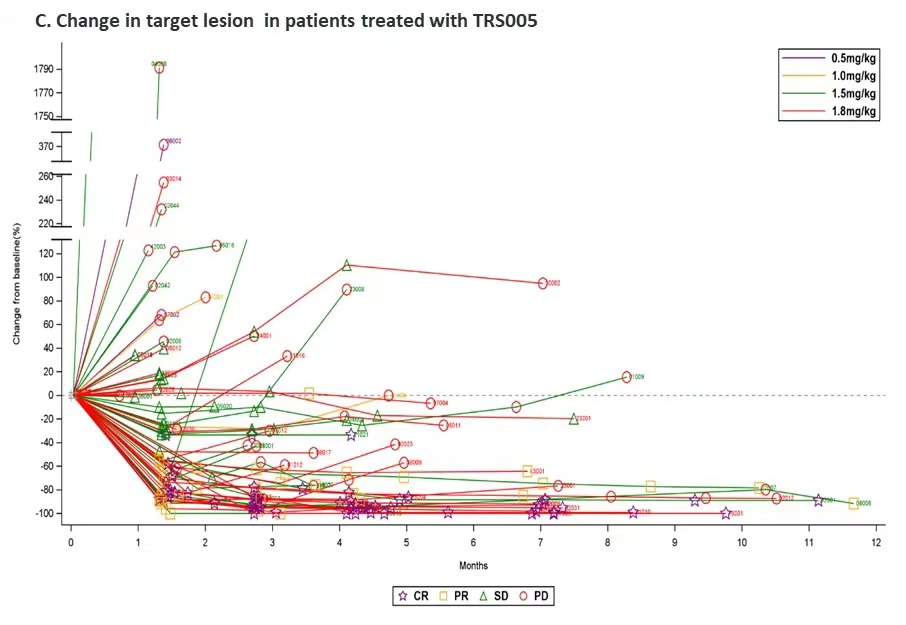
TRS005整体安全性及耐受性良好,≥3级TRAE最常见的是中性粒细胞计数下降(50.0%)、白细胞计数下降(35.6%)和淋巴细胞计数下降(14.4%),主要发生在早期(2周期内)。以21天为周期的给药频率无药物蓄积,TRS005表现出良好的线性PK特性。
研究结论
TRS005已积累了约150例患者的临床试验数据,现有结果表明,患者生存获益明显,安全性可控,耐受性良好。(临床试验注册号:NCT05395533)。
在R/R DLBCL患者中,1.8mg/kg剂量组疗效信号明显,ORR、DCR、mPFS分别为59.4%、87.5%和7.26个月。这些结果支撑了TRS005进入单臂II期关键临床试验阶段,有望给R/R DLBCL带来临床获益。
此外,TRS005在R/R NHL其他亚型中的探索也在同步开展,已取得了优异的疗效数据,待公布。一线联合用药的I期临床试验已启动,二线联合用药的IND申请也已受理。
参考文献
2024 ASCO. Abstract #3026: The anti-CD20 antibody-drug conjugates TRS005 in relapse/refractory CD20-positive B-cell non-Hodgkin lymphoma: A multicenter, open-label, single-arm, phase I study.